2023年2月3日,浙江大学公共卫生学院、附属妇产科医院夏大静/吴一华课题组在《Cancer Immunology Research》在线发表“Extracellular Vesicle-packaged circATP2B4 Mediates M2 Macrophage Polarization via miR-532-3p/SREBF1 Axis to Promote Epithelial Ovarian Cancer Metastasis”研究论文,本论文被选为该期的Cover Story。研究发现了新型环状RNA circATP2B4以EVs为载体,激发肿瘤细胞和肿瘤相关巨噬细胞(TAMs)之间的“交互作用”, 最终通过影响TAMs的极化方向促进卵巢癌进展的新机制,并揭示了circATP2B4作为卵巢癌未来诊治靶标的潜能。

卵巢癌是女性生殖系统最常见的恶性肿瘤之一,其进展主要受卵巢癌细胞及微环境相互作用的调控。由于卵巢癌早期临床症状非常隐匿、缺少有效筛查指标,患者往往预后不良。因此,寻找新的肿瘤标志物及干预靶点对卵巢癌的诊治有着重要意义。环状RNA(circRNA)是一种新型的非编码RNA,在肿瘤细胞和微环境中广泛存在, 具有较高的稳定性、保守性及表达丰度。学术界前期研究表明,肿瘤细胞衍生的粒径约20–150 nm胞外囊泡(EVs)可以作为信号载体传递其内包含的蛋白质、脂类和核酸(mRNAs、miRNAs、lncRNAs和circRNAs)分子,在肿瘤细胞和TME细胞之间的相互作用中发挥多种功能。越来越多的证据表明circRNAs可能参与了肿瘤细胞和TME之间的多方面调节机制。然而,目前关于EVs中circRNAs如何调控卵巢肿瘤微环境的机制仍不清楚。
课题组通过对上皮卵巢肿瘤组织转录组测序数据分析,发现并鉴定了卵巢癌组织中差异上调的新型环状RNA hsa_circ_0000173(circATP2B4),对卵巢癌组织样本ISH/FISH分析发现circATP2B4在肿瘤细胞中的表达上调。同时,scRNA-seq和Bulk RNA-seq分析表明卵巢癌腹膜转移样本中有巨噬细胞高丰度浸润并伴随M2极化信号增加,而且M2型巨噬细胞会导致卵巢癌患者的预后不良。更重要的是,发生转移的卵巢癌样本中circATP2B4上调表达、EVs信号表达和巨噬细胞M2极化水平呈正相关,提示了circATP2B4在肿瘤细胞-肿瘤相关巨噬细胞“交互作用”中的关键地位。
随后通过差速冷冻离心、透射电镜和qRT-PCR等技术,提取、鉴定了卵巢癌细胞的EVs,发现其具有携带和运输circATP2B4的能力。EVs示踪法显示其包裹的circATP2B4可以递送进入巨噬细胞。以双荧光素酶报告基因、荧光原位杂交、Western blotting和流式细胞术等方法研究了巨噬细胞中circATP2B4和miR-532-3p以及SREBF1表达之间的相互的作用。EVs将包裹的circATP2B4传递进入肿瘤微环境中的巨噬细胞,并作为竞争性内源RNA(ceRNA)结合miR-532-3p,抑制miR-532-3p对其靶标mRNA SREBF1的干扰作用,进入巨噬细胞中的circATP2B4可以通过调节miR-532-3p/SREBF1/PI3K/AKT轴诱导巨噬细胞的M2型极化。最后,作者进一步在动物体内水平验证了circATP2B4对卵巢癌进展和转移的潜在影响。
综上所述,课题组揭示了卵巢癌细胞可通过EVs递送的方式释放环状RNAcircATP2B4作用于巨噬细胞并诱导其M2型极化,导致肿瘤微环境的免疫抑制,进而促进卵巢癌转移的新机制。
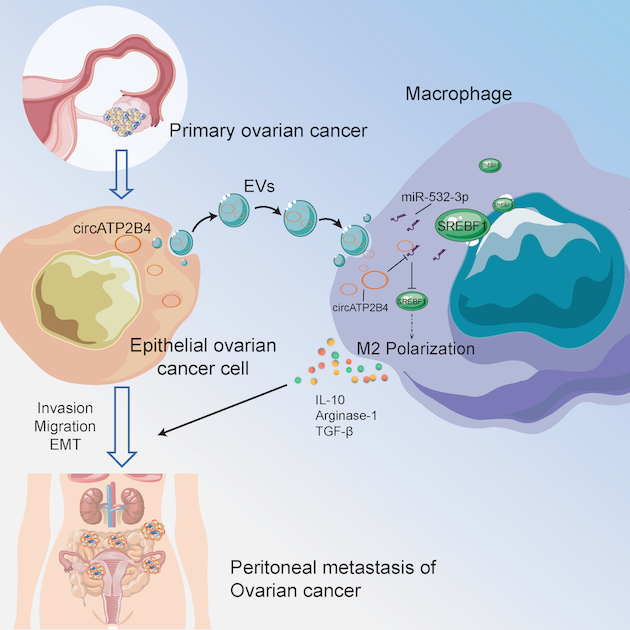
本论文的分子机制模式图
浙江大学公共卫生学院、附属妇产科医院夏大静教授和吴一华副教授为本文的通讯作者,浙江大学公共卫生学院和附属妇产科医院为共同第一完成单位。公共卫生学院2019级博士生汪舫为本文的第一作者。附属妇产科医院吕卫国教授、陈柯列博士后、郑芳博士生、医学试验班(巴德年班)牛越群博士、公共卫生学院袁晓宇博士生、秦与恒、崔臻妍硕士生为论文主要作者。本课题得到基础医学院王青青教授、王晓健教授以及姚雨石教授、澳门大学沈汉明教授的大力支持和帮助,受到国家自然科学基金、浙江省自然科学基金等资助,并得到浙江大学医学院公共技术平台和实验动物中心的支持。
原文连接:https://aacrjournals.org/cancerimmunolres/article/11/2/199/716221/Extracellular-Vesicle-Packaged-circATP2B4-Mediates


